Utilisation de la Jacinthe d'eau Eichhornia Crassipes
comme complément alimentaire pour le Tilapia Oreochromis spp
2.1. Résumé
Les résultats de ce travail de recherche réalisé au Guatémala portent sur la croissance de Tilapia (Oreochromis spp.) élevé en cages flottantes pendant 168 jours. Six régies d'élevage ont été expérimentées, en combinant trois régimes alimentaires variant en pourcentage (0, 5 et 10%) de Jacinthe d'eau séchée (Eichhornia crassipes ) et deux densités d'élevage de poissons (30 et 120 individus/m3).
Le meilleur taux de croissance (0,82 g/individu. d) a été enregistré, dans les cages contenant 120 individus/m3 et recevant un régime alimentaire comprenant 5% de Jacinthe d'eau. Le deuxième meilleur taux de croissance (entre 0,45 et 0,62 g/individu. d) a été obtenu pour les poissons des autres cages alimentés artificiellement. Les cages témoin ne recevant aucune alimentation artificielle obtiennent le dernier rang avec un taux de croissance de 0,22 g/individu. d.
Règle générale, dans les conditions expérimentales rencontrées, il fut possible de substituer 5 ou 10 % du régime alimentaire équilibré destiné à Tilapia par de la Jacinthe d'eau séchée sans causer de préjudice à la croissance des poissons.
2.2. Introduction
La Jacinthe d'eau (Eichhornia crassipes ) est considérée dans plusieurs pays tropicaux et semi-tropicaux comme une plante nuisible, car elle perturbe le transport fluvial, l'irrigation et les écosystèmes aquatiques (Gupta,1981; Lareo et Bressani,1982 ).
En examinant sa composition biochimique, on remarque qu'elle contient des éléments nutritifs intéressants pour l'alimentation des poissons. En effet, elle possède toutes les vitamines ( Liang et Lovell,1971) et tous les acides aminés (Mitsuda et al. 1978) requis pour leur croissance. De plus la Jacinthe d'eau contient sur une base sèche entre 12 et 35 % de protéine (Ahmad, 1977; Lareo et Bressani,1982) et renferme un niveau de facteurs antiphysiologiques (tanins) très bas ou presque inexistant (Lareo et Bressani, 1982).
Quelques références existent (Edwards et al. 1983, 1985) sur l'utilisation de la Jacinthe d'eau comme aliment destiné au Tilapia. Cependant, au meilleur de notre connaissance, aucune expérimentation n'a encore été réalisée avec le Tilapia élevé en cages flottantes et alimenté avec un régime contenant de la Jacinthe d'eau séchée.
Etant donné l'abondance de cette plante et son intérêt nutritionnel, il est apparu opportun de rechercher un procédé visant l'utilisation de ce macrophyte pour la production de protéines animales. A cette fin, nous avons élevé en cages flottantes des alevins d'Oreochromis spp. soumis à six régies d'élevage dans lesquelles nous avons fait varier le pourcentage d'incorporation de Jacinthe d'eau dans les régimes alimentaires et la densité d'élevage de poissons dans les cages.
Ce travail de recherche a été réalisé au Guatémala, dans le canal de Chiquimulilla, où cette plante croît à l'état naturel. Le plan d'eau suit parallèlement la côte de l'océan Pacifique et possède une longueur approximative de 60 km et une largeur moyenne de 100 m. Le site expérimental est localisé à environ 30 km de part et d'autre des embouchures, près d'une petite localité appelée Monterico, dans le département de Santa-Rosa.
2.3. Matériel et méthodes
2.3.1. Densité d'élevageLes conditions physico-chimiques des eaux du canal étant inconnues pour la période d'étude projetée, deux densités d'élevage assez faibles de poissons (30 et 120 individus/m3) ont été retenus, car, la survie des poissons à de fortes densités d'élevage serait plus durement touchée, advenant la venue de conditions environnementales limitantes.
2.3.2. Alimentation
Les trois régimes alimentaires expérimentés (Tableau 2.1) sont constitués d'ingrédients d'origine locale, disponibles en tout temps et peu coûteux, auxquels nous incorporons un pourcentage (0, 5 ou 10 %) de Jacinthe d'eau séchée.
Tableau 2.1. Formulation des régimes alimentaires (%, poid sec) destinés aux tilapias (Oreochromis spp.).
| ------------------------------------------------------------------------------------------------ | |||
| Régimes | |||
| Ingrédients --------------------------------------------------------- |
|||
|
|
1
|
2
|
3
|
|
Jacinthe d'eau
|
-
|
5,0
|
10,0
|
|
Noix de coco
|
10,0
|
9,8
|
9,3
|
|
Farine de poisson
|
15,0
|
14,0
|
13,2
|
|
Maïs
|
20,0
|
19,0
|
18,0
|
|
Farine de graine de coton
|
55,0
|
52,2
|
49,5
|
|
---------------------------------------------------------------------------------------------------
|
|||
|
Total
|
100,0
|
100,0
|
100,0
|
Un poisson de la famille des Gobidés, Dorminator latifrons est employé dans la composition du régime alimentaire de base; il est écaillé, vidé de son contenu stomacal et intestinal, puis haché.
La Jacinthe d'eau est récoltée sans sa racine, hachée en morceaux de 1 à 2 cm, moulue, séchée par ventilation forçée pendant 12 à 14 heures, puis remoulue et tamisée à travers des mailles de 0.9 mm d'ouverture.
Les autres ingrédients (maïs, graine de coton et noix de coco) sont moulus à l'aide d'un moulin à farine (modèle domestique) et tamisés à travers des mailles de 0.9 mm. Lors de la fabrication des régimes alimentaires, le maïs, la Jacinthe d'eau et le coton sont pesés individuellement à l'état semi-sec (déshydratation naturelle) ou à l'état frais, pour le poisson et la noix de coco, puis le tout est mélangé. On ajoute de l'eau à la préparation pour former une pâte malléable qui, passée à travers de la filière d'un moulin à viande, donne des filaments de 5 mm de diamètre. Ces filaments sont par la suite fragmentés à la longueur désirée, pesés en rations individuelles et réfrigérés à 6oC jusqu'à la distribution. Ces régimes humides (38,3, .42,2 et 43,1 % d'eau) sont fabriqués tous les deux jours afin d'offrir aux poissons une alimentation de qualité satisfaisante et uniforme.
Le poids sec de la ration alimentaire distribuée quotidiennement représente 4% du poids des poissons, il est ajusté à toutes les deux semaines à partir de la pesée d'un échantillon de trente individus pris au hasard dans chaque cage. Les poissons sont nourris trois fois par jour (8:00, 11:30 et 16:30 h), six jours par semaine et pendant les 168 jours de l'expérimentation.
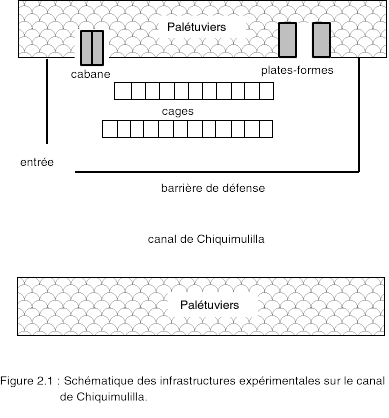 2.3.3. Cages
2.3.3. Cages
Les cages (1,0 x 1,0 x 1,25 m) sont constituées d'une armature en bois qui supporte intérieurement un filet en polyéthylène sans noeud à maille carrée (6,0 mm); elles offrent un volume fonctionnel d'un mètre cube. Les cages sont réparties aléatoirement dans l'une des deux rangées disposées parallèlement et équidistantes de 1,50 m (Figure 2.1); elle sont espacées entre elles de 60 cm et possèdent, sous le fond, une zone d'eau libre de 2,50 m.
Le système d'ancrage et de flottaison permet de relever individuellement les cages, ce qui facilite les opérations de vérification, d'entretien et d'échantillonnage. L'ensemble des viviers est entouré d'une barrière de protection avec entrée unique.
2.3.4. Dispositif expérimental
Les alevins utilisés, d'un poids moyen de 2,2 g, proviennent d'une population locale résultant de croisements entre Oreochromis mossambica , O. nilotica ou O. hornorum . Ils sont répartis de façon aléatoire dans les cages flottantes expérimentales variant en densité d'élevage (30 et 120 individus/m3) et en régime alimentaire contenant (0, 5 ou 10 % de Jacinthe d'eau) ce qui donne 6 possibilités d'élevage exécutées en duplicata. De plus, des alevins étaient aussi distribués dans deux cages témoin (sans réplicat) opérées avec deux densités d'élevage (30 et 120 individus/m3); ces groupes se nourrissaient uniquement de la nourriture naturelle présente dans l'eau (plancton). L'ensemble des 14 cages comportait un total de 1050 poissons.
2.3.5 Analyses
L'analyse de la composition chimique des régimes alimentaires est effectuée, en duplicata. Sont mesurés: les protéines brutes (Kjeldahl; N X 6,25; auto-analysateur Kjel-foss; A.O.A.C., 1980), les lipides (extraction à l'éther de pétrole pendant18 h; extracteur Goldfish; A.O.A.C., 1980), les fibres brutes totales (hydrolyse acide et alcaline, puis incinération du résidu au four à moufle à 500 oC pendant 3 h; appareil Fibertec; A.O.A.C., 1965) , les cendres (incinération d'un échantillon au four à moufle pendant 3 h à 500 oC; A.O.A.C., 1984) et la teneur en eau (séchage au four à 94 oC pendant 24 h). La teneur en glucides est déterminée par différence à partir des valeurs trouvées pour les autres constituant du régime.
Les principaux paramètres physico-chimiques de l'eau sont analysés hebdomadairement à partir d'échantillons d'eau prélevés entre 10:00 et 14:00 h, à une profondeur de 50 cm et mesurés directement sur les lieux. A cette fin, un équipement d'analyse de terrain est employé pour les paramètres suivants: pH, (Fisher Alkalid® Tester, éventail 6,0-8,5); NH3, (Hach Ammonia nitrogen test kit model NI-8); O2, (Hach dissolved oxygen test kit model OX-2P); température, (thermomètre au mercure à minimum-maximum); salinité, (réfractomètre 0-45%o) . Le nombre de cellules de phytoplancton est calculé hebdomadairement à partir d'un échantillon d'eau prélevé à 50 cm de profondeur et fixé au Lugol. La concentration moyenne mensuelle est établie en laboratoire à partir de deux décomptes de cellules par échantillon d'eau, à l'aide d'un microscope et d'un hémacytomètre.
L'étude statistique des résultats de croissance est effectuée à l'aide d'une analyse de variance selon un plan factoriel complètement aléatoire et d'analyses de variance simples et simultanées à trois niveaux.
2.4. Résultats
La composition chimique et la valeur énergétique des régimes alimentaires (Tableau 2.2) révèlent que le % de protéines brutes, de lipides et de la valeur énergétique est décroissant du régimes 1 vers le régime 3. Tandis que nous avons l'effet inverse pour le % d'humidité, de fibres et de cendre. Le % de glucides tant qu'à lui se retrouve inchangé dans les trois régimes.
| ______________________________________________________________________ | |||
| Régimes | |||
| Composantes------------------------------------------- | |||
|
1
|
2
|
3
|
|
|
------------------------------------------------------------------------------------------------------------------------
|
|||
|
Humidité
|
38,3
|
42,4
|
43,1
|
|
Protéines brutes
|
27,4
|
23,2
|
20,8
|
|
(% poids sec)
|
(44,4)
|
(40,3)
|
(36,5)
|
|
Lipides
|
3,9
|
3,3
|
2,9
|
|
Glucides (1)
|
21,0
|
21,0
|
21,7
|
|
Fibres brutes
|
4,7
|
5,0
|
6,3
|
|
Cendres
|
4,7
|
5,1
|
5,2
|
|
------------------------------------------------------------------------------------------------------------------------
|
|||
|
Total
|
100,0
|
100,0
|
100,0
|
|
Valeur énergétique calculée (KJ/g) (2)
|
1154,5
|
1031,2
|
970,2
|
1) Calculés par différence = 100 -(% d'humidité + % protéines brutes + % lipides + % de fibres brutes + % de cendres)
2) Protéines brutes = 23,7 KJ/g; lipides = 39,6 KJ/g; glucides = 16,7 KJ/g
Les analyses statistiques (Tableau 2.4.) révèlent qu'il n'y a aucune différence significative (p>0,05) entre le poids moyen initial des individus pour l'ensemble des cages, mais qu'il y en a une dans le poids moyen final, pour certaines cages. Le meilleur taux de croissance enregistré (0,82 g/individu .d), provient des cages contenant 120 individus/m3 alimentés avec un régime comprenant 5% de Jacinthe d'eau séchée. Cette performance est supérieure à celle de l'ensemble des poissons recevant une alimentation artificielle et dont les taux de croissance s'établissent entre 0,45 et 0,62 g/ individu.d. Les plus faibles taux de croissance (0,17 et 0,20 g/ individu . d ) sont ceux des poissons élevés dans les deux cages témoin (30 et 120 individus/cages) uniquement alimentés avec le plancton naturel présent dans le cours d'eau.
____________________________________________________________
La figure 2.2 établit clairement la décroissance marquée de la concentration du phytoplancton dans le milieu naturel de la première à la quinzième semaine alors qu'elle atteint pratiquement une valeur nulle. Par la suite, une remontée rapide de la concentration du phytoplancton permet de retrouver, à la 24e semaine, une valeur similaire à la valeur initiale.
La figure 2.3 illustre les courbes de croissance obtenues dans les diverses conditions. On peut distinguer, tout spécialement durant les dernières semaines, quatre familles de courbes: la première (5% de Jacinthe, 120 individus/m3) montre un fort taux de croissance qui se maintient tout au long de l'expérience; la seconde famille a trait aux deux autres concentrations de Jacinthe utilisées (0 et 10 %) avec 120 poissons/m3; la troisième famille regroupe tous les groupes de poissons à 30 individus/m3; enfin, la quatrième famille de courbes a trait aux deux cages témoin (poissons alimentés seulement de la seule nourriture naturelle). Dans ce dernier cas, une tendance à un taux de croissance supérieur s'amorce à partir de la 18e-20e semaine de l'expérience.
Pour les individus des cages recevant une alimentation artificielle, l'indice de conversion alimentaire, compris entre 2,6 à 3,1 kg de nourriture sèche/kg de poids frais produit (Tableau 2.4), se compare aux valeurs de la littérature pour des poissons placés dans les conditions similaires (Coche, 1977; Phillipart et al. 1979; Guerrero, 1980).
L'analyse statistique des résultats de croissance (Tableau 2.5) montre que, tous autres facteurs confondus, l'alimentation artificielle entraîne un gain de poids significativement supérieur (p< 0,05) à celui assuré par la seule nourriture naturelle. En ce qui a trait aux densités d'élevage utilisées (30 vs 120 individus/m3), la plus forte densité permet d'obtenir un poids moyen final significativement (p< 0,05) supérieur avec l'aliment artificiel. Avec l'alimentation naturelle, le poids final moyen est, aux deux densités d'élevage utilisées, significativement inférieur (p< 0,05) à celui obtenu avec l'aliment artificiel, même à la densité d'élevage de 30 individus/m3.
Enfin, si l'on considère que le facteur % d'inclusion de Jacinthe d'eau dans les régime artificiel, le poids final moyen atteint est le même dans les trois cas (0,5 et 10% de Jacinthe d'eau).
La mortalité des poissons s'est située aux environs de 2 % dans les cages témoin et à 5 % pour l'ensemble des autres cages; les poissons morts n'étaient pas remplacés et ces décès ont été principalement attribuables aux manipulations lors des relevés morphométriques. Aucune présence de parasites ou de pathogènes visibles n'a été détectée pendant l'expérimentation.
Des signes de reproduction (oeufs ou des alevins dans la cavité buccale) sont apparus, dans certaines cages, chez quelques femelles d'un poids supérieur à 30,0 g.
2.5. Discussion
Peu de travaux scientifiques ont porté sur l'utilisation de la Jacinthe d'eau dans les régimes alimentaires destinés aux poissons. Liang et Lovell (1971) mentionnent que l'addition en petite quantité (5 à 10 %) de cette plante séchée à des régimes pauvres en vitamines réduit la mortalité et accentue la croissance des alevins du Poisson-chat (Ictalurus punctatus ). Edwards et al. (1983, 1985) ont obtenu des taux de croissance statistiquement significatifs avec O. nilotica élevé en bassin et en étang et alimenté avec de la Jacinthe d'eau compostée.
L'utilisation de cages flottantes permet l'entrée de la microflore et de la microfaune naturelles; ainsi, l'inclusion de deux cages témoin (alimentation naturelle seulement) dans le dispositif expérimental (Tableau 2.4) a permis d'observer et d'apprécier l'influence de ces organismes sur la croissance de Tilapia. La figure 2.3, montre que les poissons des cages témoin manifestent une croissance du même ordre de grandeur que les poissons des groupes alimentés artificiellement jusqu'à la huitième semaine. A la suite de quoi, leur taux de croissance devient faible ou nul jusque vers la vingtième semaine, alors que celui des poissons alimentés artificiellement continue à augmenter. Cet arrêt de la croissance chez les poissons des cages témoin coïncide avec la diminution marquée du phytoplancton naturel (Figure 2.2) et la reprise de la croissance correspond à la réapparition de la source d'aliments naturels.
L'examen des résultats finals des individus (Tableau 2.4) recevant l'alimentation artificielle indique que le taux de croissance varie en fonction des différents paramètres étudiés. Ainsi, nous constatons que parmi les densités d'élevage de poissons expérimentées, celle de 120 individus/m3 présente le meilleur taux de croissance (Tableau 2.5). Cette augmentation reliée à la densité d'élevage dépend selon Haller (1974) et Balarin et Haller (1979) de certains mécanismes de reproduction. Ces derniers sont inhibés et l'énergie normalement dépensée durant cette période (défense du territoire, construction de nids, parades, formation de gamètes, etc) est plutôt utilisée pour la croissance du poisson. Allison et al. (1976) sur ce même sujet, ont constaté que Sarotherodon aureus peut être gardé à de très fortes densités dans de petits bassins aérés sans effets négatifs sur la croissance et que la reproduction pouvait être pratiquement éliminée. Swingle (1956), travaillant avec le Poisson rouge (Carassus auratus L.), le poisson-buffle (Megastomatobus cyprinella Valenciennes), la Carpe allemande (Cyprinus carpio L.) et certains autres poissons, partage un point de vue différent: il suggère que la limitation.
de l'espace ambiant ("space factor") n'est pas réellement responsable de l'inhibition de la reproduction à de fortes densités d'élevage; mais que ce phénomène est principalement relié à la présence d'une sécrétion hormonale ou d'un produit d'excrétion qui agit comme facteur inhibiteur. Le relevé des paramètres physico-chimiques des eaux (Tableau 2.3) effectué tout au long de l'expérimentation révèle que les valeurs sont comprises dans une fourchette favorable à la croissance du Tilapia (Redner et Stickney,1979; Caulton,1982; Chervinski,1982; Stickney,1986). Dans des conditions physico-chimiques similaires, certains auteurs utilisent des densités d'élevage variant entre 250-500 individus/m3 et récoltent une biomasse élevée de bonne qualité (Suwanasart,1972; Coche, 1977; Guerrero,1979; Phillipart et al. 1979). Ainsi, la densité d'élevage aurait probablement pu être accrue tout en maintenant un rapport qualité-quantité optimal.
Pour le deuxième paramètre étudié, l'alimentation, il semble à prime abord que l'ajout de la Jacinthe d'eau dans les régimes alimentaires n'améliore que faiblement le taux de croissance du Tilapia. Cependant, deux points sont à considérer dans l'évaluation de ces résultats:
a) les régimes incorporant de la Jacinthe d'eau contiennent une teneur en protéines, lipides et en énergie inférieure au régime de base (Tableau 2.2). Malgré ces différences, les poissons nourris avec les régimes contenant de la Jacinthe d'eau ont globalement des résultats de croissance du même ordre de grandeur que ceux alimentés avec le régime de base (Tableau 2.4 et 2.5). Il est donc possible de substituer 5 ou 10 % du régime de base par de la Jacinthe d'eau sans affecter la croissance du Tilapia.
b) il est probable que l'influence bénéfique de l'incorporation de Jacinthe d'eau dans l'alimentation de Tilapia serait ressortie plus nettement avec l'emploi d'un régime de base moins diversifié ou nutritionnellement moins complet que celui utilisé lors de cette expérience, comme c'est probablement souvent le cas dans les pays en développement. En effet, le tableau 2.1. indique que les ingrédients employés dans la formulation du régime de base proviennent de plusieurs sources (végétale et animale), ce qui minimise les carences alimentaires. Le tableau 2.2 montre que la quantité de protéines présente dans ce régime est égale et même supérieure à celle recommendée pour plusieurs espèces de tilapias (Hughes, 1977; Davis et Stickney, 1978; Balarin et Haller, 1982) et que le pourcentage de lipides incorporé aux régimes alimentaires destinés à Tilapia peut-être supérieur à 25% sans déclencher de problèmes hépathiques (Lager et al., 1962).
L'incorporation de la Jacinthe d'eau séchée est bénéfique à de faibles pourcentages; quel pourcentage maximal pourrait être incorporé à un régime alimentaire? Selon Liang et Lovell (1971), des alevins de Poissons-chat (I. punctatus ) peuvent accepter, après conditionnement, jusqu'à 40 % de Jacinthe d'eau séchée dans leur régime alimentaire, mais le gain en poids et la prise alimentaire diminuent. Ces auteurs, ainsi que Edwards et al. (1985) avec O. nilotica , proposent que la quantité de fibres constitue un obstacle à l'utilisation de grandes quantités de Jacinthe d'eau séchée dans l'alimentation des poissons, car ceux-ci ne peuvent dégrader la cellulose.
Dans un système d'élevage fermé (bassins, étangs), cet obstacle peut-être contourné en partie. Edwards et al. (1983) mentionnent que O. nilotica nourri d'un mélange "Jacinthe d'eau et féces compostées" montre des résultats de croissance intéressants. Edwards et al. (1985) réussirent à remplacer, sans conséquence négative sur la croissance d'O. nilotica élevé en bassins, 75% d'un régime alimentaire équilibré par de la Jacinthe d'eau séchée ou compostée. Les auteurs concluaient que le Tilapia ne bénéficie pas seulement des éléments nutritifs contenus dans la Jacinthe d'eau, mais profite aussi de l'apport nutritionnel que représentent les micro-organismes croîssant dans les bassins d'élevage. En effet, l'emploi d'un système expérimental fermé permet aux déchets métaboliques, à la portion de Jacinthe d'eau et du régime alimentaire non assimilés, d'être colonisés et dégradés par une microflore complexe (bactéries, algues, champignons et protozoaires). Pour le Tilapia, ces organismes et leurs sous-produits (acides aminés, peptides et lipides) constituent un apport alimentaire non négligeable ( Bowen,1982; Hepher et Pruginin, 1982; Edwards et al. 1983; ).
Ainsi, le système d'élevage fermé offre l'avantage de permettre la transformation de matières indigestes en substances organiques assimilables par le Tilapia. Cependant, il ne permet pas l'utilisation de fortes densités d'élevage de poissons par volume d'eau et, par conséquent, produit une biomasse moindre comparée à celle obtenue lors des élevages en cages flottantes.
L'expérience de Edwards et al. (1985) met aussi en valeur un second aspect de l'importance des micro-organismes dans la transformation de la matière organique indigeste en substances digestibles. Ils notent que le taux de croissance des individus nourris avec des régimes contenant de la Jacinthe d'eau compostée est supérieur à celui des individus nourris avec des régimes incluant de la Jacinthe d'eau sous forme sèche.
En considérant les qualités nutritionnelles de la Jacinthe d'eau (vitamines, acides aminés essentiels et minéraux) et les avantages qu'offre la dégradation bactérienne lors du compostage, il serait intéressant, pour les pays aux prises avec des problèmes d'envahissement par la Jacinthe d'eau, d'utiliser par le biais de l'aquaculture cette plante aquatique dans la production de protéines animales. Un moyen à retenir joindrait les avantages de l'élevage en cages flottantes (densités d'élevage élevées de poissons, gestion simple, faible reproduction, croissance rapide et uniforme des poissons, taux de survie élevé, récolte facile, etc) (Coche,1977; Balarin et Hatton, 1979) avec ceux offerts par la Jacinthe d'eau compostée dans les régimes alimentaires. Parmi les effets bénéfiques de l'utilisation de la Jacinthe d'eau comme complément alimentaire destiné aux Tilapias, mentionnons que la présence de tous les nutriments essentiels augmentrait la résistance aux maladies, la survie et la croissance de ces derniers. Finalement, l'utilisation massive de la Jacinthe d'eau pour des fins d'élevage minimiserait où réduirait en partie l'impact néfaste de cette dernière sur l'environnement, la navigation fluviale et sur l'irrigation, tout en constituant une source alimentaire peu coûteuse.